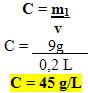Concentração comum (C) ou simplesmente Concentração é definida como:
Matematicamente ela é expressa pela fórmula:
onde:
C = Concentração comum e sua unidade no SI é dada em g/L;
m1 = massa do soluto* em g;
v = volume da solução em L.
O símbolo C é de comum e não de concentração, pois existem outros tipos de concentração (concentração molar ou molaridade, concentração em partes por milhão ou ppm, porcentagem em massa do soluto ou título em massa, concentração em volume, etc.).
Conforme mostrado acima, a concentração de uma solução tem como unidade padrão g/L (gramas por litro), porém ela pode ser expressa em outras unidades de massa e volume, como g/m3, mg/L, kg/mL, etc.
Dessa forma, se dissermos que uma solução de água e açúcar tem concentração de 50 g/L, quer dizer que em cada litro da mistura (solução e não do solvente) tem dissolvida uma massa de 50g de açúcar.
No cotidiano, a concentração é muito usada para indicar a composição de alimentos, medicamentos e materiais de limpeza e higiene que são líquidos. Observe o rótulo do leite integral abaixo, que analisa a concentração de vários nutrientes como carboidratos, proteínas e gorduras totais presentes em 200 mL da solução.
Por exemplo, em cada 200 ml do leite, tem-se 9 g de carboidratos. Transformando para litros e fazendo os devidos cálculos conforme mostrado abaixo, temos que a concentração de carboidratos nesse leite é de 45 g/L.
• Transformando a unidade do volume para o Sistema Internacional, ou seja, de mL para L:
1 L ------1000 mL
v -------200 mL
v = 0,2 L
• Calculando a concentração de carboidratos no leite:
Isso significa que em cada litro desse leite, tem-se 45 g de carboidratos.
* Em aspectos quantitativos referentes às soluções químicas, sempre que em uma grandeza aparecer o índice 1, ele indica que a grandeza é só do soluto. O índice 2 se refere ao solvente e quando não houver índice nenhum, estará se referindo à solução inteira (soluto + solvente).
Por Jennifer Fogaça
Graduada em Química